√ダウンロード 炭酸水素ナトリウム イオン反応式 746785
水酸化物,炭酸塩,炭酸水素塩の分解反応である。これら は電気分解や光分解のような電子移動を伴う酸化還元反応 とはいえない。そして,特に炭酸水素ナトリウムの熱分解 の実験が,中学の一番はじめに導入されるために反応を単 に暗記と考えやすい。Q170 ①硫酸銅cuso 4 水溶液と鉄②硫酸鉄feso 4 水溶液と銅③硝酸銀agno 3 水溶液と銅④酢酸鉛pb(ch 3 coo) 2 水溶液と亜鉛のイオン反応式. q168 ブランクテストの意味とその必要性. q164 炭酸水素ナトリウムの膨張.炭酸水素イオン 炭酸水素イオン(たんさんすいそいおん、hydrogencarbonate, HCO − 3 )は炭酸の1段階目の電離により生成し、炭酸水素塩中に存在する1価の陰イオンである。 このイオン を重炭酸イオン(じゅうたんさんいおん、bicarbonate)と呼ぶこともある。例えば、NaHCO 3 は「炭酸水素ナトリウム

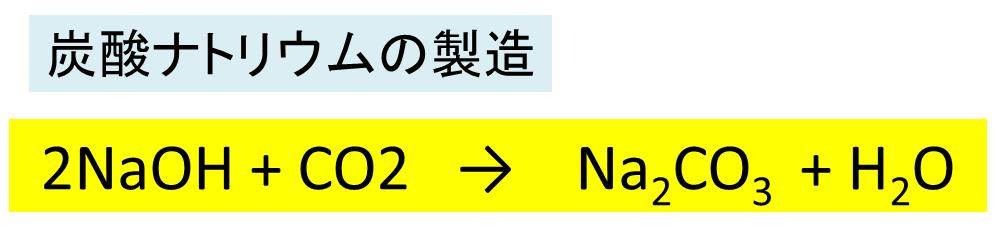
炭酸水素ナトリウム Nahco3 の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸ナトリウムの工業的製法
炭酸水素ナトリウム イオン反応式
炭酸水素ナトリウム イオン反応式-というイオン反応式になります。 所長 「中和反応とは、酸から生じる水素イオン 例:硫酸水素ナトリウム・NaHSO 4 、炭酸水素ナトリウム金属の反応(酸化と還元) (1) ナトリウムと水の反応 ナトリウム・Naは、 酸化され、陽イオン・Na+になる。①式 2Na → 2Na+ + 2e- 水・H2Oは還元され、 水素・H2と水酸化物イオンOH -を生じる。②式



炭酸水素ナトリウムの製法 性質 用途とは わかりやすく解説 わかりやすく解説 科学をわかりやすく解説
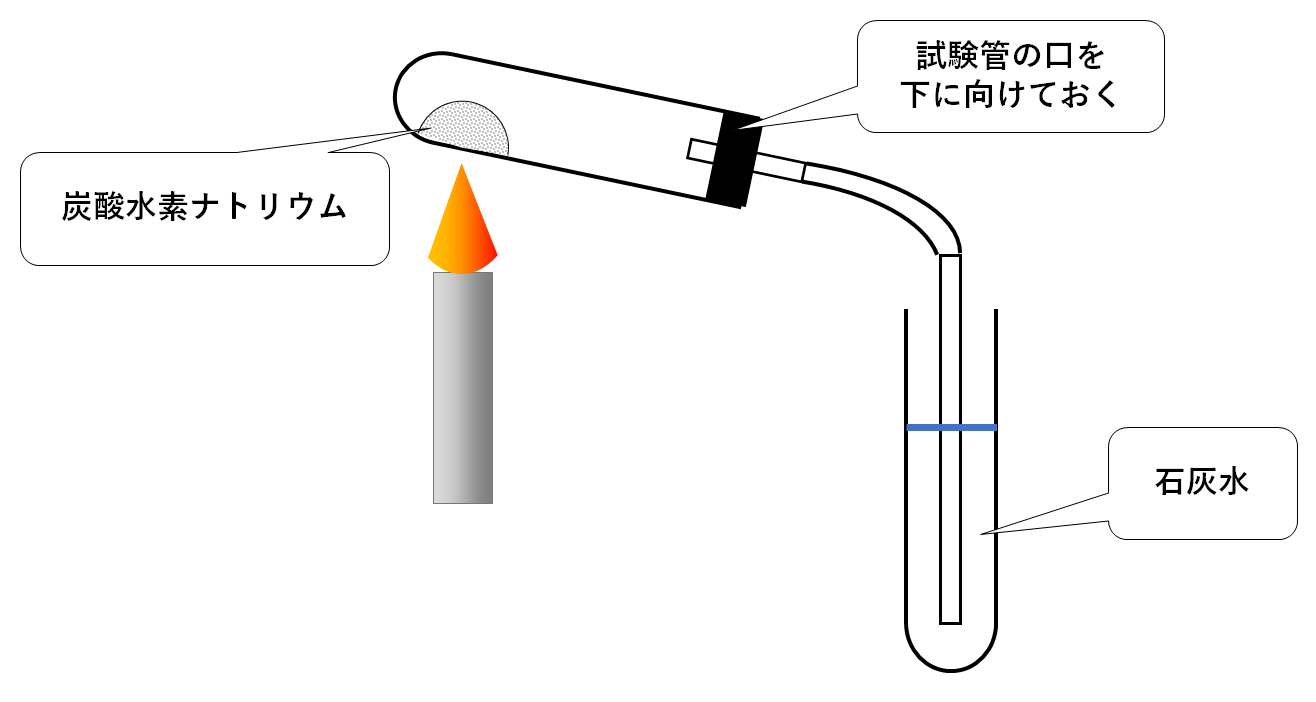
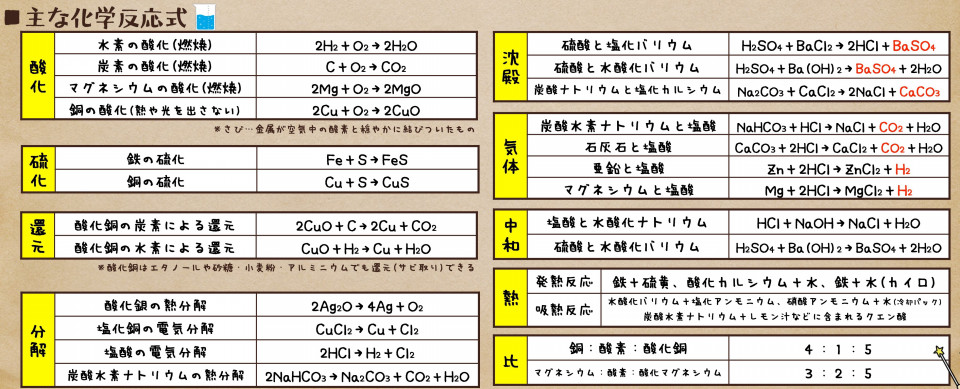
熱分解の生成物である炭酸ナトリウムNa 2 CO 3 と反応物である炭酸水素ナトリウムNaHCO 3 は,ともに白色の粉末ですね。 水に対する溶解性と,水溶液の液性が異なりましたね。水溶液の液性といっても,ともに塩基性です。ここでは、炭酸水素ナトリウムの基礎的な性質 について解説していきます。 ・炭酸水素ナトリウム(nahco3)の分子式・示性式・構造式・電子式・分子量・イオン式は? ・炭酸水素ナトリウムと二酸化炭素の反応により、炭酸ナトリウムを生成する反応式 炭酸水素ナトリウムと塩酸の反応 NaHCO 3 HCl → NaCl CO 2 H 2 O 炭酸水素ナトリウムのナトリウムと、塩酸の塩素が反応して塩化ナトリウムになり、二酸化炭素が発生して水
炭酸の水中での反応式は以下のようになります。 h2co3 ⇄ h hco3 hco3 ⇄ h co32 また、炭酸は弱酸なのでイオンより分子の方が存在しやすいです。 質問者様の反応式は多分炭酸ナトリウムなどの炭酸と強塩基との塩を水に溶かした時の反応式だと思います。有効主成分である炭酸水素ナトリウムは,約100℃ 以上で加熱されると急速に分解して下記の反応式で示 す通り水と二酸化炭素を放出し,炭酸ナトリウム ボイラ エアヒーター 排風機 凝縮器 冷却塔 脱硫塔 煙突 表1 特殊重曹製剤の粉体物性物質量と化学反応式 15 米6,000粒 16 シリンジで気体の分子量を測定する 17 炭酸水素ナトリウムと塩酸の反応 化学反応 サプリメントに含まれるビタミンc量を調べる 21 金属樹の生成と金属のイオン
後ろから読むと「ナトリウム」、「水素」、「炭酸」です。 これを一つずつ順番に化学式にすると、 nahco 3 となります。 ちなみに 「炭酸」は co 3 と覚えておいてください。 また、炭酸水素ナトリウムを熱分解すると下記のような化学反応式になります nahco 3 は炭酸水素塩の1つ。 したがって、熱分解反応入試頻出3パターンの反応式の作り方などを解説にあるように、熱分解するとh 2 oとco 2 と炭酸塩(ここではna 2 co 3 )になる。 全体の反応式 最後に、step1からstep5の反応を1つの式にまとめてみよう。 \ 炭酸水素ナトリウム(Sodium hydrogencarbonate)は,化学式NaHCO 3 で表される無機化合物です。 炭酸水素イオン −1 1 強酸との反応 炭酸水素ナトリウムと強酸が反応すると,弱酸の炭酸(続けて二酸化炭素と水に分解)が遊離します。




炭酸水素ナトリウムを水に溶かした際に生じる炭酸イオンの濃度は 次の 化学 教えて Goo




炭酸水素ナトリウム Nahco3 の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸ナトリウムの工業的製法
塩化カルシウムと炭酸水素ナトリウムを水中にて反応させて、炭酸カルシウムを生成させる時の反応式について教えてください。以下に自分の考えをかきます。CaCl2 NaHCO3 = CaCO3 NaCl2 H等モル反応で反応が進むかたちであっています反応式の各物質の係数比や,イオンの価数に注目して化学式を表すこと。各反応式はそれぞ れ次のようになる。 (1) 酸と塩基の反応である。 2ch 3coohca( oh) 2→ca( ch 3coo) 22h 2o (2) 塩と酸の反応である。石灰水にco 2 を吹き込むとcaco(i) 弱酸遊離反応 酢酸ナトリウム ch 3 coona はイオン結合性の塩であり、水中では酢酸イオン ch 3 cooとナトリウムイオン na とに完全電離しています。そして、この水溶液に希塩酸 hcl を加えると、水溶液中の水素イオン h が増加し、式 (ii) の平衡が右へ




炭酸水素ナトリウムの製法 性質 用途とは わかりやすく解説 わかりやすく解説 科学をわかりやすく解説



中2化学 分解 中学理科 ポイントまとめと整理
回答 酢酸ch3coohは、炭酸h2co3よりも強い酸です。電離度が大きいと言います。電離度の計算式は割愛しますが興味があれば簡単に知ることができます。 炭酸は h2oco2→h2co3 という反応式で表すことができ、二酸化炭素が水に溶けてできた酸です。多くの人は逆反応で出てきた二酸化炭素の泡の化学反応式 化学変化4 鉄と硫黄の混合物を加熱すると,硫化鉄がで きる。 化学反応式 化学変化5 酸化銅と炭を混ぜて加熱すると,二酸化炭素 が発生し,金属の銅ができる。 化学反応式 化学変化6 炭酸水素ナトリウムとうすい塩酸が混ざる その炭酸イオンが水と反応することで炭酸水素イオン(hco₃⁻)と水酸化物イオン(oh⁻)を生みます。水酸化物イオンが増えれば塩基性を示すので、これによって炭酸水素ナトリウムの水溶液は塩基性を示します。 na₂co₃→ 2na co3²⁻




本当に知らなきゃ損なのか 重曹の活用法を化学的に考察してみる Reasonable Way Of Life



炭酸水素ナトリウム You Iggy
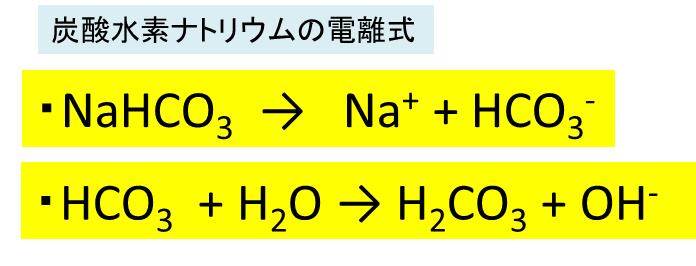
化学反応式 塩化銅→銅+塩素 CuCl2→Cu+Cl2 塩酸→水素+塩素 2HCl→H2+Cl2 塩化ナトリウム→ナトリウム+塩素 2NaCl→2Na+Cl2 酸化銀→銀+酸素 2Ag2O→4Ag+O2 炭酸水素ナトリウムで炭酸水素イオンからギ酸イオンへの還元反応が進行した.また,ギ酸イオン生成量は添加水素量の1/2 乗 に比例し,反応容器表面に解離吸着した水素分子によって炭酸水素イオンが還元された.還元反応の初期段 階における反応速度式をdHCOONa/dt = NaHCO3 H2例) 炭酸水素ナトリウム nahco 3 nahco 3 → na + + hco 3 - 炭酸水素イオン hco 3 - は弱酸のイオンで, h 2 o と反応するので oh - が残る。 hco 3 - + h 2 o → h 2 co 3 + oh - 強酸と弱塩基からできる塩→〔 酸 〕性




Excel 化学反応式の練習用教材 中学理科ポイントまとめと整理 オンラインショップ



亜硫酸水素ナトリウムに希硫酸を加えると生成物は亜硫酸だと思ったのですが Yahoo 知恵袋
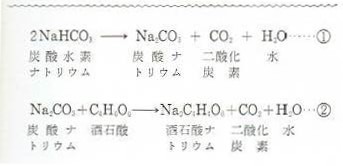
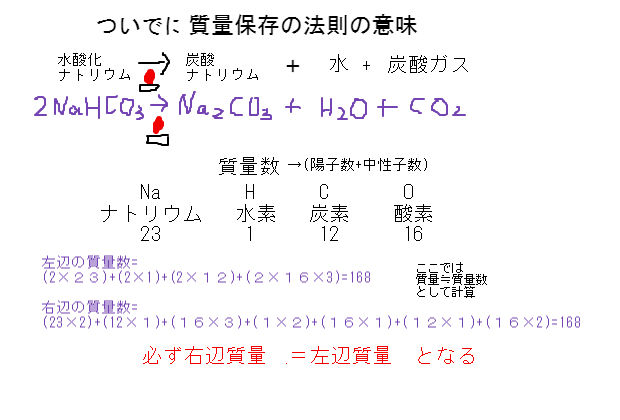
炭酸水素ナトリウム(重曹)は化学式nahco 3 であらわされる化合物で、体内でna とhco 3に解離する。 hco 3は重炭酸イオンと呼ばれ、酸を中和しこの反応をイオン反応式 で示せ。 (4) 上記7 つの陽イオンのうち, NH3 と錯イオンを形成する陽イオンが3 つある。 3 つの陽イオンを選び, 対応する錯イオンの構造を次の(a)〜(e) から選べ。 (a) 正八面体 (b) 正六面体 (c) 正四面体 (d) 正方形 (e) 直線炭酸水素ナトリウム→炭酸ナトリウム+ 二酸化炭素 にさんかたんそ +水 の分解が起こる。 この反応を化学反応式で表すと, 2nahco 3→na 2co 3+co 2+h 2o となる。 ※出題頻度「分解〇」「炭酸ナトリウム〇」「水〇」「二酸化炭素〇」 「2nahco 3 →na 2 co 3




炭酸ナトリウム Wikipedia



至急 500枚 中学の宿題です 僕じゃわからないので この化学反応式を解い Yahoo 知恵袋
炭酸 h 2 co 3 の電離反応より,その電離定数 k c1 と k c2 ~式(10)を連立させて,水素イオン濃度 3.3 炭酸ナトリウム na 2 co 3 と炭酸水素ナトリウム nahco 3 の混合溶液の塩酸 hcl炭酸水素ナトリウム→炭酸ナトリウム+ 二酸化炭素 にさんかたんそ +水 の分解が起こる。この反応を化学反応式で表すと, 2nahco 3→na 2co 3+co 2+h 2o となる。 ※出題頻度「分解〇」「炭酸ナトリウム〇」「水〇」「二酸化炭素〇」 「2nahco 3 →na 2 co 3(7)過不足のある場合の水素イオン濃度 例題.015 mol/L の硫酸100 mL と010 mol/L の水酸化ナトリウム水溶液100 mL の 混合液のpH を求めよ。 i 酸塩基のそれぞれの物質量を求める H2SO4:015 × 100 1000 = 0015 mol



1




高校化学 芳香族化合物の分離の基本 映像授業のtry It トライイット
両性電解質水溶液の水素イオン濃度 15 年8 月5 日 炭酸水素ナトリウム水溶液中では、nahco3 は、na とhco 3 に完全に電離している。 ここで、 hco 3 は、 hco 3 ⇀↽ h hco 3 (1) と電離して、水素イオンを放出できる(酸として働く) が、hco 3 は弱酸h2co3(つまりは、co2) の 共役塩基であるので、水に溶けにくいと水酸化物イオンも出ないからアルカリ性も弱くなる ゲスト 1年以上前 炭酸水素ナトリウムの方が水に溶けにくいのは、炭酸ナトリウムよりも水にくっつきにくいから ここら辺は高校の分野だからぼやっと覚えるくらいでいいかも この炭酸水素ナトリウムを加熱すると、水と二酸化炭素が発生する。 また、加熱後の固体は加熱前の物質とは異なる物質で、炭酸ナトリウムという。 6・7 炭酸水素ナトリウムの熱分解のまとめ まとめ化学反応式で表してみましょう。



炭酸水素ナトリウム




めちゃめちゃ至急です 明日 31日 の朝までに知りたいです Clearnote
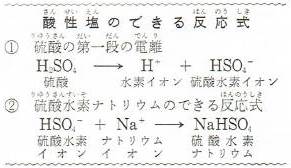
炭酸ナトリウムや炭酸水素ナトリウムの場合は,炭酸 (二酸化炭素水溶液) が弱酸 であるので,それぞれ次の反応式によって塩基性を示す。 na 2 co 3 ―→ 2 na + + co 3 2 co 3 2+ h 2 o hco 3+ oh nahco 3 ―→ na + + hco 3 hco 3 co 2 + oh炭酸水素イオン hco3 <その他の組成式> 炭酸水素ナトリウム nahco3 硫酸水素ナトリウム nahso4 亜硫酸水素ナトリウム nahso3 酢酸ナトリウム ch3coona 二酸化ケイ素 sio2 1次の酸の電離をイオン反応式で表し,生じた陰イオンの名称を答えよ。水素が発生 亜鉛Zn 水素が発生 アルミニウムイオン,亜鉛イオンと少量の水酸化ナトリウム水溶液の反応をイオン反応式で表すと, アルミニウムイオン,亜鉛イオンにアンモニア水を加えたときの変化をイオン反応式で表すと,



化学の質問です 炭酸ナトリウム水溶液で Co3 2 H2o Yahoo 知恵袋



炭酸ナトリウム Na2co3 の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸ナトリウムの工業的製法
ナノバブル化した炭酸水では、水素イオンが発生するかと思ったので、 炭酸ナトリウムNa2CO3 106gに含まれるナトリウムイオンNa は何 反応式の左辺で、メタノールと酸素分子は 2 3 の mol 比で反応しますから、「メタノール 028 mol と酸素分子 042 mol が示した300 度,3 時間処理での炭酸水素ナトリウムの 水熱還元反応によるギ酸イオンの生成量とほぼ等し く,式1と式2は平衡反応であると考えられる. 4 まとめ 水熱条件下で炭酸水素ナトリウムの水素還元反応 を行った結果,炭酸水素ナトリウムはギ酸ナトリウ




炭酸水素ナトリウム Nahco3 の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸ナトリウムの工業的製法



炭酸水素ナトリウム Nahco3 の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸ナトリウムの工業的製法




中2理科 炭酸水素ナトリウムの分解 化学反応式を覚えるコツ Youtube
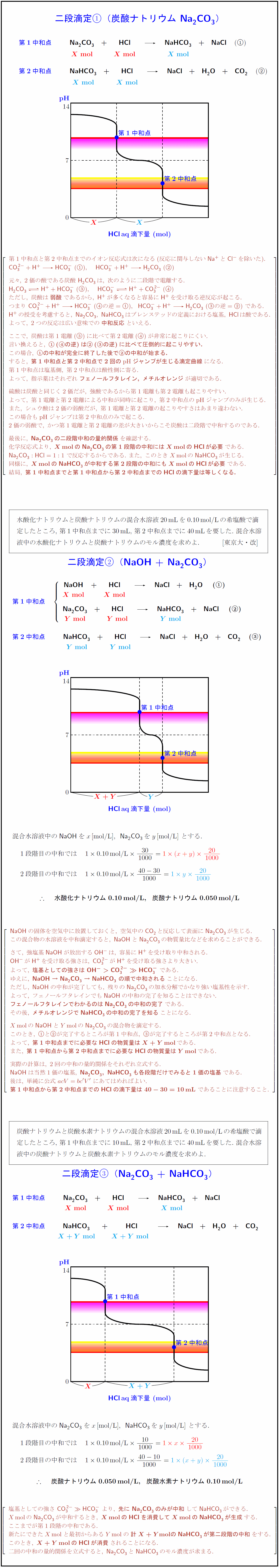



高校理論化学 二段滴定 炭酸ナトリウムna Co Naoh Na Co Na Co Nahco 受験の月




炭酸水素ナトリウムの化学反応式 超絶な覚え方 Youtube




炭酸水素ナトリウム Wikipedia




理科質問 炭酸水素ナトリウムの分解の化学反応式 Youtube




化学反応式 中学生の学習法 Shun Ei Note




中2理科 炭酸水素ナトリウムの分解 映像授業のtry It トライイット




炭酸水素ナトリウムを熱分解した時の化学反応式を求める問題があるんですけど 化 Clearnote
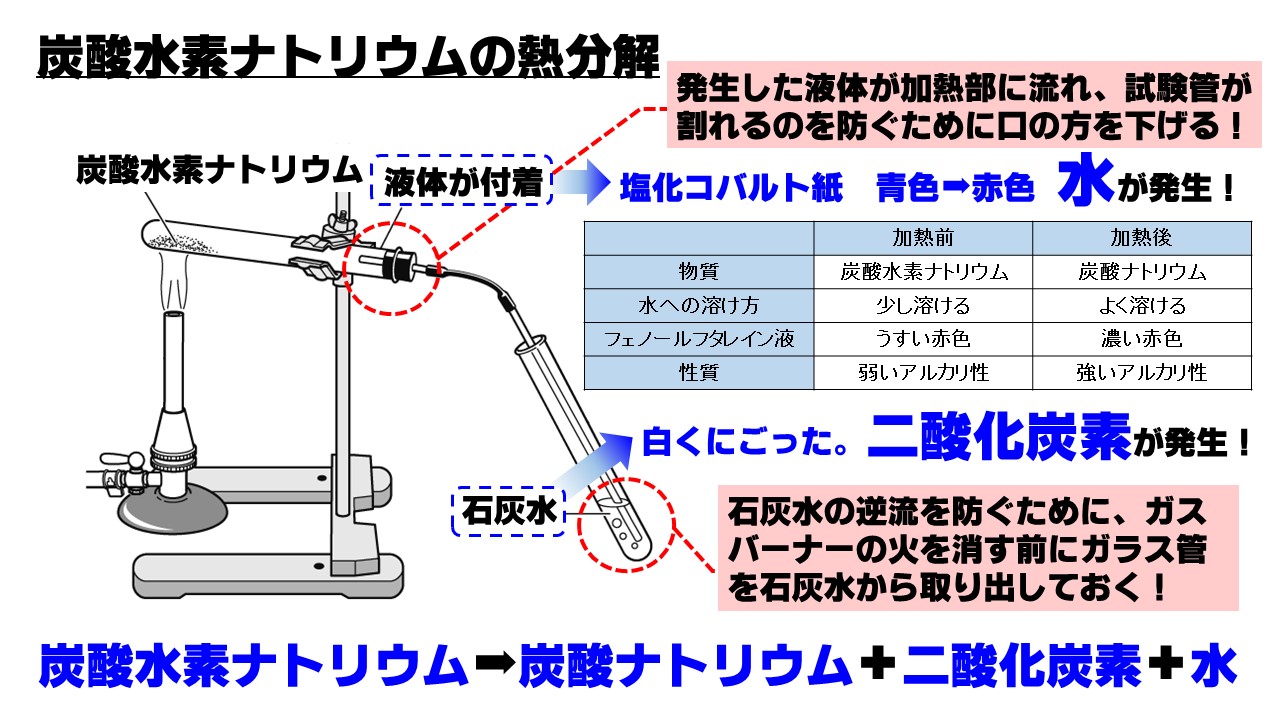



中2理科 炭酸水素ナトリウムの熱分解のポイント Examee




重曹を使ったウイルス対策メモ 2 5 3 7追記 ゆんたくの輪




夕凪亭別館 写真館 10 化学反応式




化学でチャレンジ 重曹 と クエン酸 を使った炭酸水の作り方 持続可能な農業 養殖ビジネス
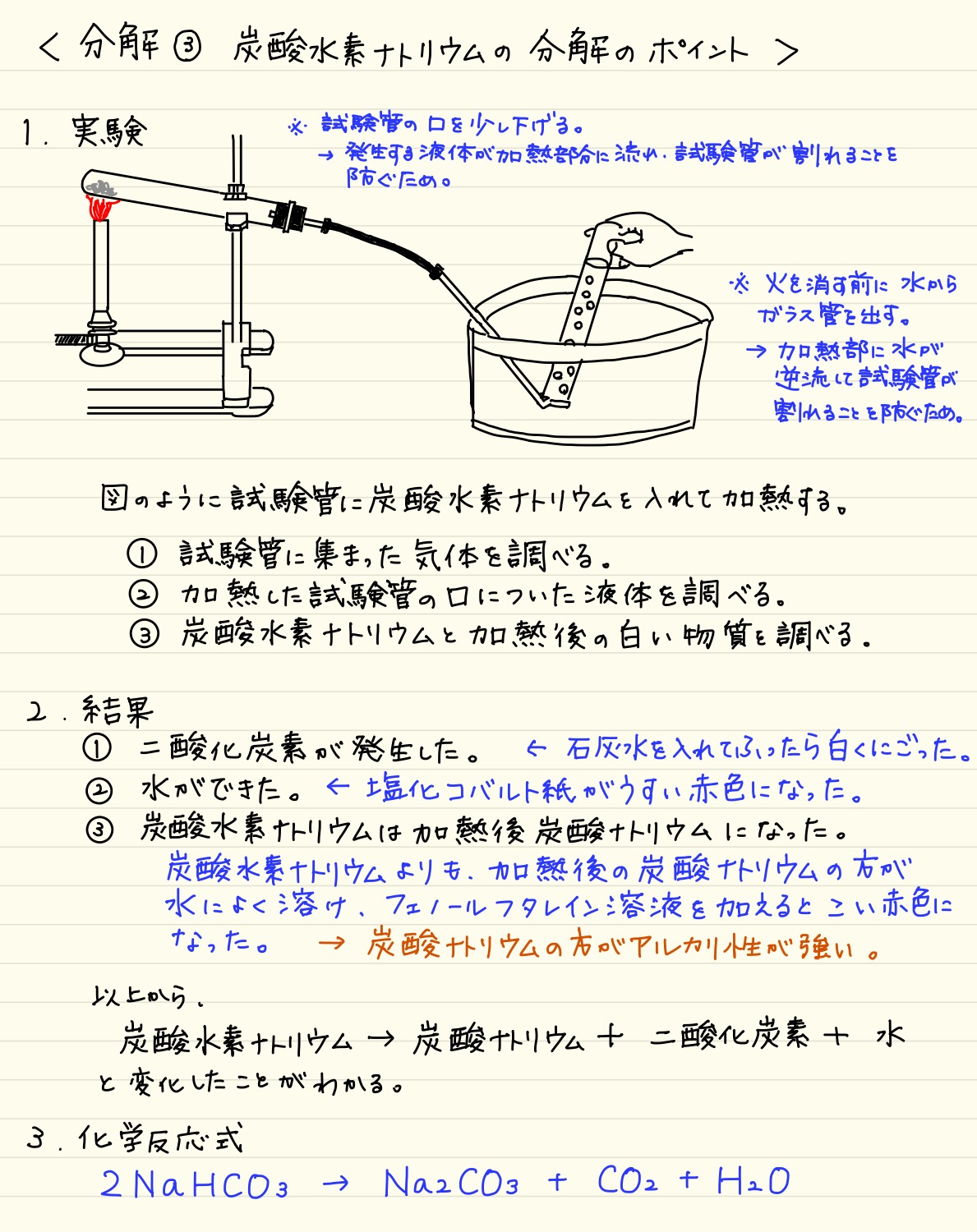



分解 炭酸水素ナトリウムの分解のポイント 塾の質問箱
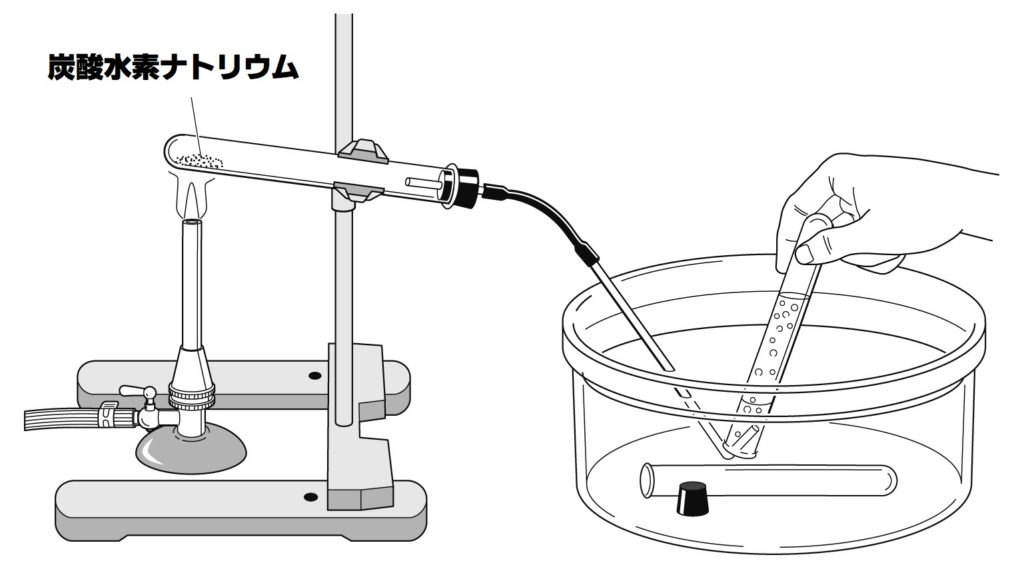



中2理科 炭酸水素ナトリウムの熱分解の定期テスト対策問題 Examee




理科 中2 7 化学反応式の作り方 Youtube




炭酸水素ナトリウムの化学反応式ってなんですか 誰か教えてください இdஇ Clear




炭酸水素ナトリウムの水溶液が塩基性なのはなぜ 化学反応式を解説 地学博士のサイエンス教室 グラニット



化学の熱分解反応についての質問です 炭酸水素カルシウム水溶 Yahoo 知恵袋




炭酸水素ナトリウムの水溶液が塩基性なのはなぜ 化学反応式を解説 地学博士のサイエンス教室 グラニット



正塩 酸性塩 塩基性塩とは わかりやすく解説 科学をわかりやすく解説



中学理科の化学式や化学反応式まとめテスト付 化学反応式の作り方や元素記号の覚え方も簡単に解説します 第二の家 ブログ 藤沢市の個別指導塾のお話
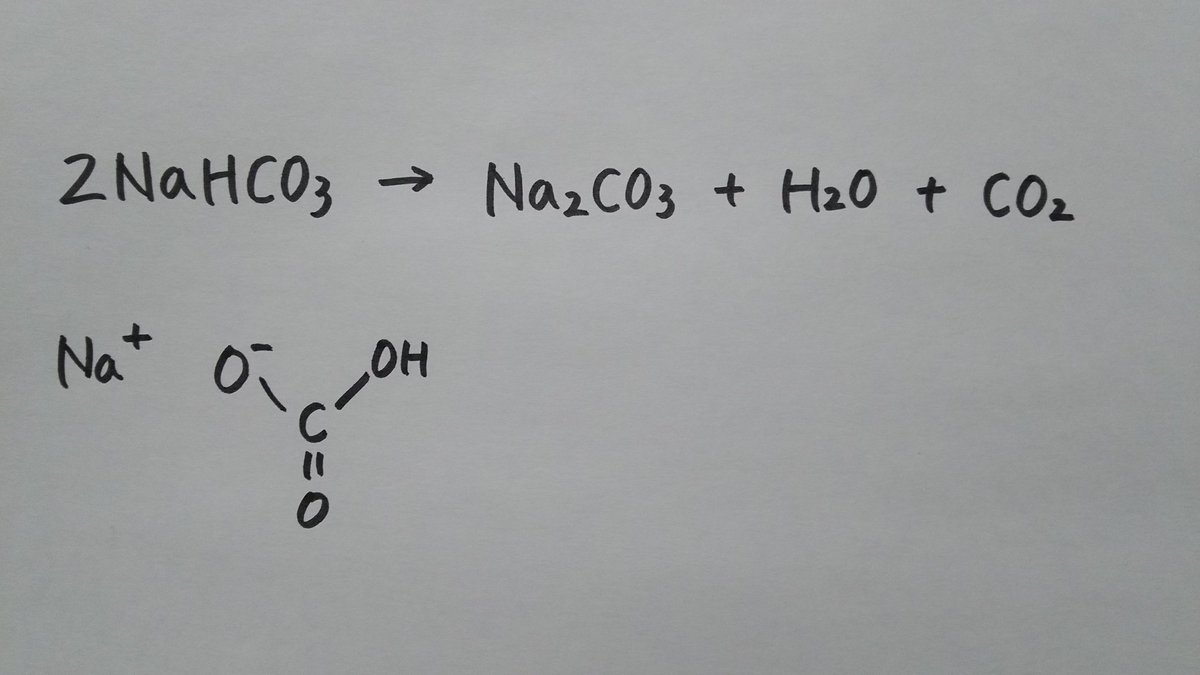



Naoko 先日 親戚の子 中2 に化学式教えてと泣き付かれた 件の反応式は炭酸水素ナトリウムの熱分解 炭酸水素naってベーキングパウダーだよ お菓子に混ぜると膨らむやん つまり二酸化炭素出てるってこと と とりあえず感覚的な説明 でも



スズケンdiアワー 平成14年7月11日放送内容より スズケン Di実例集 137 昭和大学病院 薬剤部 竹ノ内 敏孝 血漿重炭酸イオン濃度の算出法 本日は 酸 塩基代謝障害と血漿重炭酸イオン濃度の算出法についてお話させていただきます まず 酸 塩基



受験理系特化プログラム Xyz



炭酸水の作り方 クエン酸 重曹 究建築研究室 Q Labo
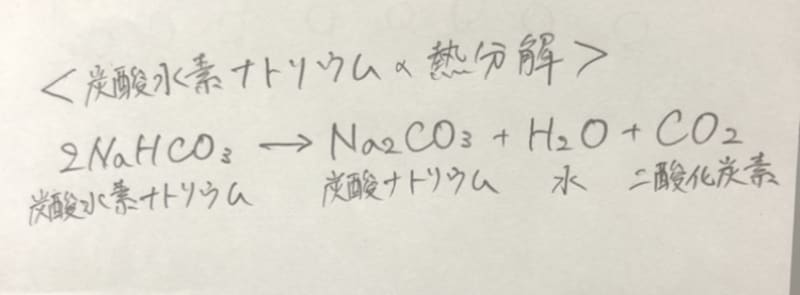



炭酸水素ナトリウムの化学反応式を教えてください アンサーズ




炭酸水素ナトリウムの熱分解 中学理科 By かたくり工務店 マナペディア




炭酸水素ナトリウムの水溶液が塩基性なのはなぜ 化学反応式を解説 地学博士のサイエンス教室 グラニット




第3類医薬品 炭酸水素ナトリウム 3g 12包 お中元 あわせ買い2999円以上で送料無料




分解 酸化銀の分解のポイント 塾の質問箱




炭酸水素ナトリウム Wikipedia




โน ตของ 炭酸水素ナトリウムの分解 ช น Junior Clearnote




炭酸水素ナトリウムの水溶液が塩基性なのはなぜ 化学反応式を解説 地学博士のサイエンス教室 グラニット



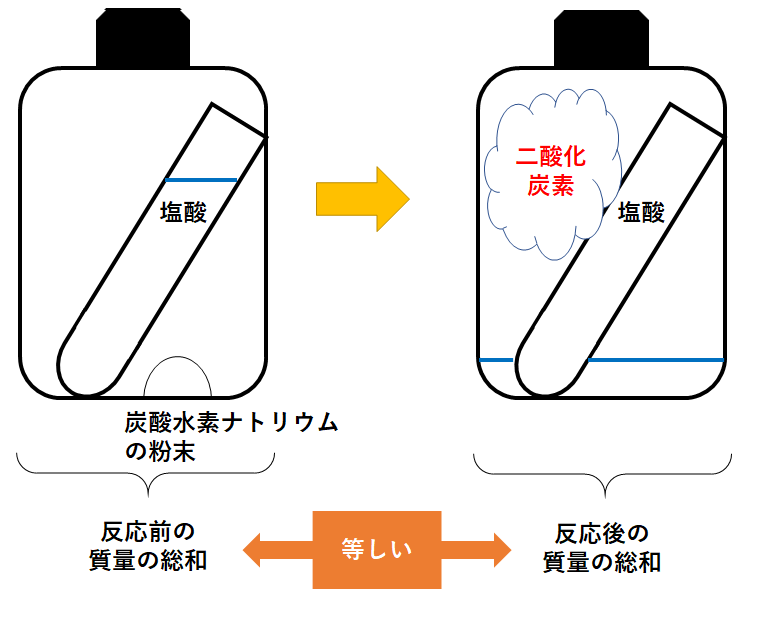
炭酸水素ナトリウムの加熱分解と質量保存のやっかいな問題 中学数学 理科 寺子屋塾の復習サイト




炭酸水素ナトリウムはなぜアルカリ性を示すのか 反応式を使ってわかりやすく解説 ジグザグ科学 Com




夕凪亭別館 写真館 10 化学反応式




炭酸水素ナトリウムの化学反応式を教えてください Clearnote




無機化学の予備知識




中2理科 硫化鉄や炭酸水素ナトリウムなどの化学反応式 試験に出る暗記用リスト Irohabook




炭酸水素ナトリウムの分解の化学反応式はこうやって覚えよう 塾長の独り言




炭酸水素ナトリウムの水溶液が塩基性なのはなぜ 化学反応式を解説 地学博士のサイエンス教室 グラニット




炭酸水素ナトリウムの水溶液が塩基性なのはなぜ 化学反応式を解説 地学博士のサイエンス教室 グラニット




なぜ炭酸水素ナトリウムは塩基性なのに弱酸の遊離が起こるのですか Clearnote




中2 理科 化学 炭酸水素ナトリウムの分解 17分 Youtube



ひたすら受験問題を解説していくブログ慶應大学医学部13年化学第1問



炭酸ナトリウム 分子モデル



炭酸水素ナトリウムの加熱分解実験




中2化学 分解 中学理科 ポイントまとめと整理



1



中2化学 質量保存の法則 中学理科 ポイントまとめと整理




炭酸水素ナトリウムの水溶液が塩基性なのはなぜ 化学反応式を解説 地学博士のサイエンス教室 グラニット
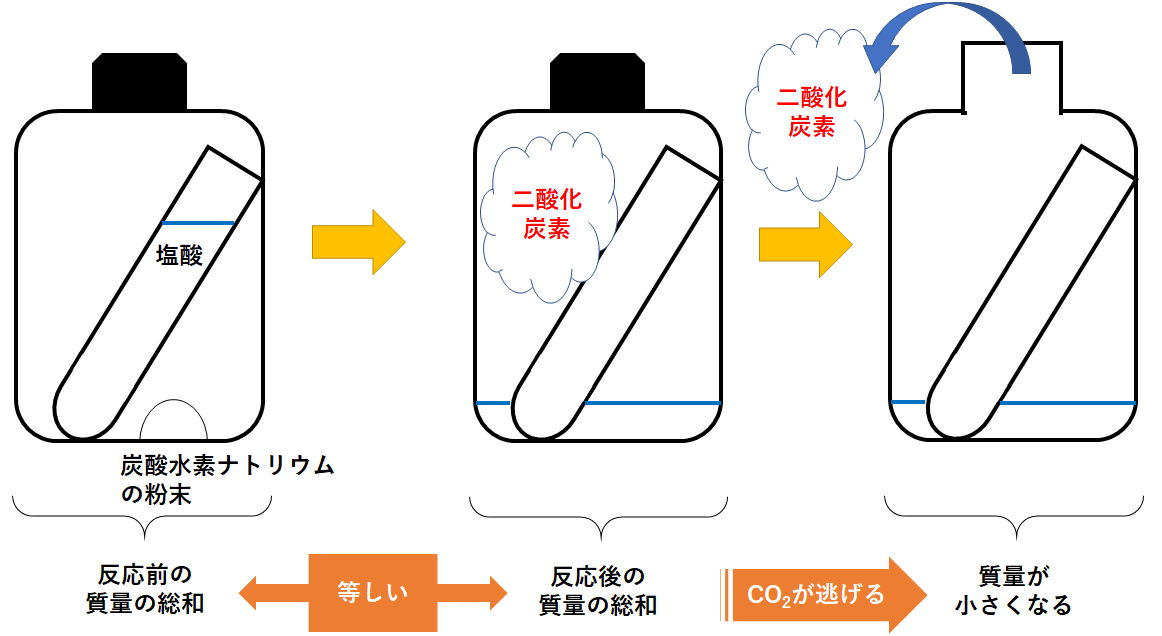



中2化学 質量保存の法則 中学理科 ポイントまとめと整理




中2化学 化学変化と原子 分子 定期テスト対策 過去問演習 受験 ガチ勢 チート Web問題集サイト



2 o 問1 次の各化学反応式に係数を入れよ




夕凪亭別館 写真館 10 化学反応式



2 o 問1 次の各化学反応式に係数を入れよ



化学基礎で質問です 下の化学反応式について 炭酸水素ナトリウムが8 4gだった Yahoo 知恵袋



炭酸水素ナトリウム You Iggy



炭酸水素ナトリウムの分解を化学反応式で教えてください 写真の黄色 Yahoo 知恵袋



炭酸ナトリウム Wikipedia



2 o 問1 次の各化学反応式に係数を入れよ




炭酸ナトリウム Na2co3 の化学式 分子式 構造式 電子式 イオン式 分子量は 炭酸ナトリウムの工業的製法




炭酸水素ナトリウムの水溶液が塩基性なのはなぜ 化学反応式を解説 地学博士のサイエンス教室 グラニット




化学式 一覧表 Minecraftの最高のアイデア




中学理科 ゴロ合わせ 炭酸水素ナトリウムの分解 Youtube




Excel 化学反応式の練習用教材 中学理科ポイントまとめと整理 オンラインショップ



Kuwabara J Esnet Ed Jp



重曹 クエン酸 炭酸水 ひらけごま



チオ硫酸ナトリウム水溶液と炭酸ナトリウム 日々の雑記帳




炭酸水素ナトリウムの水溶液が塩基性なのはなぜ 化学反応式を解説 地学博士のサイエンス教室 グラニット




炭酸水素ナトリウムの水溶液が塩基性なのはなぜ 化学反応式を解説 地学博士のサイエンス教室 グラニット




中2理科 炭酸水素ナトリウムの熱分解の定期テスト対策問題 Examee



重曹に水を加えると炭酸水素ナトリウムと水と二酸化炭素が出来るという化学反応式は Yahoo 知恵袋




炭酸水素ナトリウムとうすい塩酸を混ぜ合わせると何という気体が発生するか物質名 Clearnote




補講 炭酸の平衡 炭酸水素ナトリウムのph Youtube




19 号 炭酸水素ナトリウムのin situ変換で促進されたアミン薬物の経皮送達 Astamuse
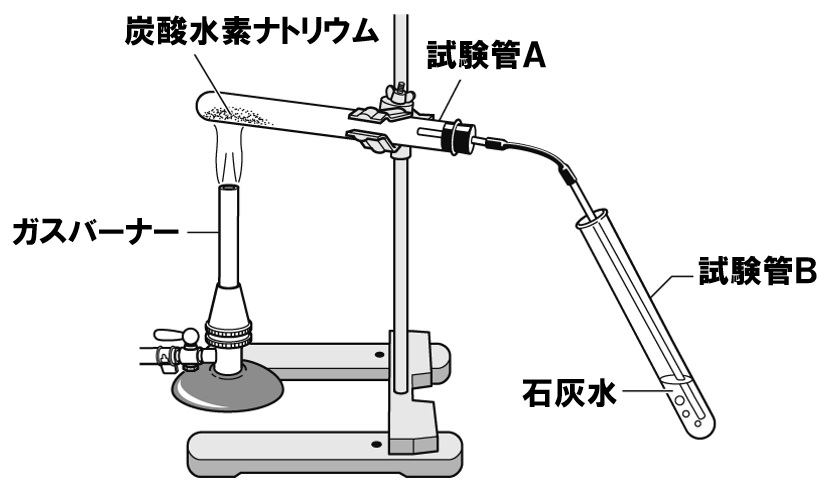



中2理科 化学変化 テスト対策問題 Examee




なぜクエン酸は酸性で 重曹はアルカリ性なのか 両者の意外な関係とは 日本霜降社




のやり方を教えてください なんでカルボン酸ナトリウムになるのですか Clearnote



炭酸水素ナトリウム 重曹 とベーキングパウダーの化学反応式について教えて Yahoo 知恵袋
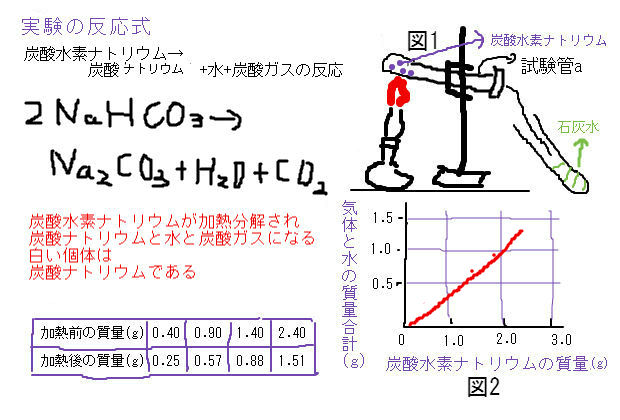



炭酸水素ナトリウムの加熱分解と質量保存のやっかいな問題 中学数学 理科 寺子屋塾の復習サイト



炭酸水素ナトリウムが加水分解したときの反応式と そのときになぜ弱塩基性だとわ Yahoo 知恵袋
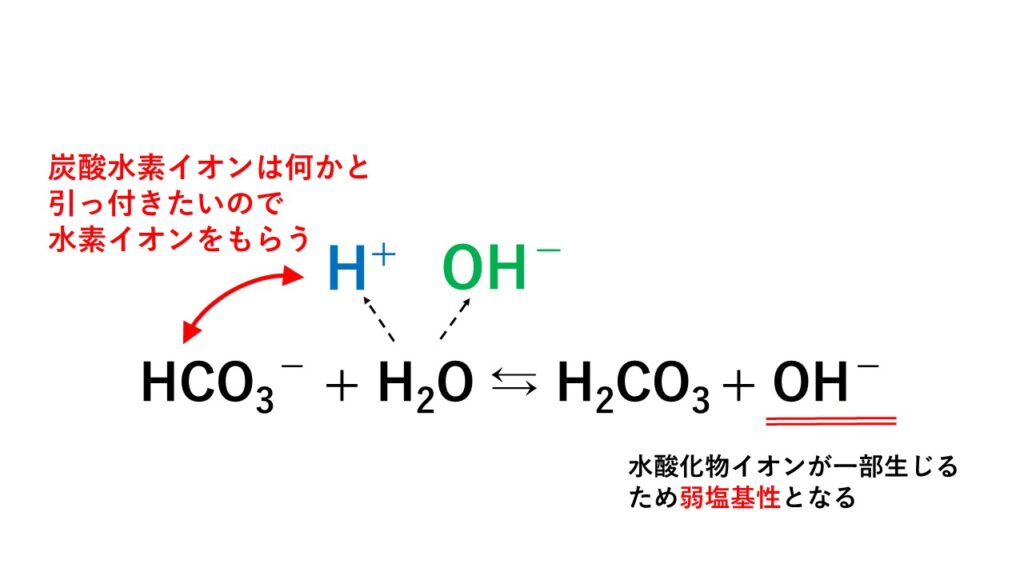



5分でわかる 塩の加水分解と塩の種類と分類 液性を解説 サイエンスストック 高校化学をアニメーションで理解する




イオン式 電離式まとめ 中学理科 ポイントまとめと整理




小テストあり 中2理科 化学反応式




中2 化学 化学反応式 中学理科を楽しくわかりやすく
コメント
コメントを投稿